CO2 ist physikalisch und thermodynamisch völlig Irrelevant für atmosphärische Schwankungen. Sehen wir uns das lebenswichtige Spurengas, welches im menschlichen Körper zu Kohlensäure Bicarbonat assimilliert wird, etwas genauer an. Das Kohlensäure-Bicarbonat-Puffersystem ist der wichtigste Blutpuffer zum Auffangen von pH-Schwankungen im menschlichen Blutkreislauf.
Die Biosphäre benötigt zur Bildung von Biomasse CO2, Sonnenlicht und Wasser (C3 Pflanzen). Wenn CO2 in Pflanzen assimiliert wird, entsteht über das Enzym Rubisco, Ribulose 1.5. Dieses neue Molekül ist hochgradig instabil und zerfällt in zwei Moleküle 3-Phosphoglycerat (3-PG).
Nach der Phosphorylierung wird durch die Reduktion der speziellen Glycerinaldehyd-3-phosphat-Dehydrogenase, Gluconeogenese-Metabolit Glycerinaldehyd-3-phosphat (GAP) gebildet. Ein wichtiger Punkt im Calvin-Zyklus.
In jedem Umlauf wird ein Molekül CO2 fixiert. nach jeweils drei Umläufen steht in der Bilanz ein Molekül der Triose GAP zur Verfügung. Insgesamt sind also 3 CO2 Moleküle zur Bildung des GAP notwendig.
Ein GAP steht für die Biosynthese zur Verfügung, und zwar entweder zur Bildung des als Speicherstoff dienenden Polysaccharids Stärke im Stroma der Chloroplasten von Pflanzen oder nach Ausschleusen über die Zwíschenstufe Dihydroxyacetonphosphat (DAP) und im Gegentausch zu anorganischem Phosphat (Pi) zur cytosolischen Synthese des Disaccharids Saccharose.
Umso mehr CO2 in der Atmosphäre vorhanden ist, umso grösser werden die Pflanzen wie Bäume, Gemüse, Früchte, ehemals Wüstenflächen ergrünen, usw.!
Form von O-C-O erlaubt nur 2 Haupt-Bindungsdehnungs-, 1 Biege- und 1 Rotationsmodi, die zu einer Infrarotabsorption führen. CO2 absorbiert bei λ = 15 μm und λ = 4.25 Infrarotwärme. Die stärkeren Linien bei λ = 4.25 μm, u = 11,75, erfahren eine 100-mal kleinere Überlappung zur schwarzen Körper Strahlung, als die Linien nahe 15 μm. Dementsprechend kann dieses Band nur einen kleinen Beitrag zur absorbierten Energie leisten.
Die Absorptionswahrscheinlichkeit und damit die Absorbtion einer spezifischen Linie ist proportional zum Produkt pv(j) (1 – pc(j)). Die Boltzmann-Statistik bestimmt die Besetzungswahrscheinlichkeit 7, pv, c (j) = exp (- Ev, c (j) / kBT).
Nach einem Absorptionsereignis befindet sich das CO2-Molekül in einem angeregten Zustand mit einer geschätzten Lebensdauer, τrad = (uj / ∆uj)2 / ν ≈ 6μs 6μs für die 15 μm Linie. Dies entspricht der spontanen Strahlungszerfallsrate, Rrad = 1,7x10hoch5 s-1. Kollisionen mit den dominanten Gasen der Atmosphäre führen zu einem nicht strahlenden Zerfall. Auf Meereshöhe und T = 288 K ist die Kollisionsrate aller Gasmoleküle etwa umgekehrt zur mittleren freien Zeit zwischen den Kollisionen. Sein Wert ist 7 x 10hoch9 s-1. Die aktuelle CO2-Konzentration beträgt cco2 = 400 ppm. Dies führt zu einer nicht strahlenden Kollisionsrate mit dem CO2 Rnon = 28 x 10hoch5 s-1. Die Chancen der Strahlungsemission in dieser Situation sind durch Rrad / (Rrad + Rnon) ≈ 0.06 gegeben. In der Troposphäre, in der der größte Teil der Absorption stattfindet, erwärmt der größte Teil der vom CO2 aufgenommenen Energie die dominanten atmosphärischen Gase. Dies ist jedoch in der Stratosphäre und noch höheren Ebenen nicht mehr der Fall, wo die Kollisionsrate dramatisch abnimmt.
Die Atmosphäre weist eine starke Druck- und Temperaturabhängigkeit bei der Höhe über dem Meeresspiegel auf.
Die Absorptionsfestigkeit hängt stark von der daraus resultierenden großen CO2-Konzentrationsschwankung ab.
Zunächst betrachten wir eine isotherme Atmosphäre von T = 288 K mit einer exponentiellen barometrischen Druckabhängigkeit. Die charakteristische barometrische Höhe, bei der der Druck im Vergleich zum Meeresspiegel auf 1 / e fällt, ist x0= 7996 m hoch9. Die Annahme einer konstanten Temperatur ist erfahrungswidrig. Es neigt dazu, die Absorption zu überschätzen, da die Temperatur für alle x < 12 km sinkt. Reduzierte Temperaturen implizieren eine geringere Wahrscheinlichkeit für den Grundzustand und eine geringere Absorption. Zweitens beinhalten die halben Breiten der Absorptionslinien Kollisionen und Dopplerverschiebungen. Diese Werte werden auch bei hohen atmosphärischen Werten reduziert. Diese Tatsache führt wiederum zu einer leichten Überschätzung der Absorption. Wir nähern die CO2-Absorption für eine bestimmte Linie an durch
α(x, uj) = α0(uj) exp(– x / x0),
IR-Absorptions- und Rückstrahleffekt (Photonenrecykling) kann vernachlässigt werden.
Den etwas umfangreicheren Berechnungsteil habe ich an dieser Stelle übersprungen.
Ich habe ∆Fmax und ∆Tmax für vier Konzentrationen berechnet, nämlich 400 ppm, 800 ppm, 2000 ppm und 4000 ppm. Sie können sehr genau mit logarithmischer Konzentrationsabhängigkeiten ausgestattet werden. Wir erhalten die folgenden Ausdrücke für ∆Fmax / Wm-2 und ∆Tmax / K, wenn wir cco2 in ppm messen und auf 400 ppm normieren.
∆Fmax = 1.881 loge (cco2 / 400),
und
∆Tmax = 0,347 Loge (cco2 / 400).
Eine Verdoppelung des derzeitigen cco2-Wertes führt zu ∆T < 0,24 K. Der zehnfache Wert von cco2 ergibt ∆T < 0,80 K. Diese moderaten Temperaturanstiege sind überhaupt nicht kritisch.
Hier die Studie von F. K. Reinhart, Swiss Federal Institute of Technology, Lausanne.
Studie von Dr. Thomas Allmendinger (2017).
Weitere 75 Studien welche belegen, dass CO2 niemals ein Klimawirksames-Spurengas war und es auch nie sein wird.
Was ist CO2?
Kohlenstoffdioxid ist ein farb- und geruchloses Spurengas. Es ist mit einer Konzentration von ca. 0,04 % (derzeit 400 ppm entspr. 0,0403 %) ein natürlicher Bestandteil der Luft. Untersee-Schlote, Vulkane, tektonische Risse und die Weltmeere selbst stossen CO2 aus. Wird es wärmer, stossen die Weltmeere mehr CO2 aus als sie aufnehmen und wenn es kälter wird, nehmen die Weltmeere mehr CO2 auf, als sie ausstossen. Das wird als "Ausgasung" oder "Eingasung" bezeichnet.
Es entsteht sowohl bei der vollständigen Verbrennung von kohlenstoffhaltigen Substanzen unter ausreichendem Sauerstoff als auch im Organismus von Lebewesen als Kuppelprodukt der Zellatmung. Das CO2 wird dabei über den Atem abgegeben. Umgekehrt sind Pflanzen, manche Bakterien und Archaeen in der Lage, CO2 durch die Kohlenstoffdioxid-Fixierung in Biomasse umzuwandeln. So produzieren Pflanzen beispielsweise bei der Photosynthese aus anorganischem CO2 Glukose.
Physiklaische Eigenschaften
Wärmeaustausch
Beim Wärmeaustausch zwischen Atmosphäre und Erdoberfläche sind zwei grundsätzlich verschiedene Austauschmechanismen beteiligt.
Wärmeaustausch via Konvektion:
Die Wärme wird durch Stöße von Molekülen untereinander übertragen. Je schneller sich die Moleküle bewegen, desto mehr Energie, sprich Wärme kann übertragen werden, desto wärmer ist die Umgebungsluft. Die Art der Gasmoleküle ist dabei beliebig, d. h. Konvektionswärme kann von Stickstoff, Sauerstoff, Wasserdampf, Argon, Kohlendioxid, Methan, flüchtigen Kohlenwasserstoffen und anderen Gasen in der Atmosphäre übertragen werden. Konvektionswärme kann in der Gesamtbilanz nur von warm nach kalt fließen (2. Hauptsatz der Thermodynamik), da die Temperatur der Atmosphäre von unten nach oben abnimmt, kann keine Konvektionswärme aus der kalten Atmosphäre wieder zurück Richtung Erdoberfläche fließen und die Erdoberfläche erwärmen oder für eine verzögerte Wärmeabgabe verantwortlich sein. Dieser Mechanismus scheidet für eine Wärmeübertragung von der Atmosphäre in Richtung Erdoberfläche aus.
Wärmeaustausch via Infrarotstrahlung:
Infrarot (IR)-Strahlung ist eine elektromagnetische Strahlung, für deren Absorption und Emission bestimmte Voraussetzungen gelten. Ein Gasmolekül muss zwingend entweder ein permanentes oder ein sich während der Molekülschwingung veränderndes Dipolmoment aufweisen. Stickstoff, Sauerstoff und Argon haben weder ein permanentes noch ein sich während der Molekülschwingung veränderndes Dipolmoment, sie können daher Infrarotstrahlung weder absorbieren noch emittieren.
Bei der Absorption von Infrarotstrahlung geht das Molekül vom Grundzustand in einen angeregten Schwingungszustand über, bei der Emission von Infrarotstrahlung geht das Molekül vom angeregten Schwingungszustand in der Grundzustand zurück und die überschüssige Energie wird dabei als IR-Photon abgestrahlt.
Kohlendioxid ist ein Molekül aus einem Kohlenstoff- und zwei Sauerstoffatomen die linear und symmetrisch angeordnet sind. Es besitzt daher kein permanentes Dipolmoment. Da sich das Dipolmoment während einer asymmetrischen Schwingung verändert, kann Kohlendioxid Infrarotstrahlung absorbieren und sie wieder emittieren. Kohlendioxid besitzt ausschließlich zwei Absorptionsbanden, die von zwei energiegleichen asymmetrischen Schwingungen (2350 cm-1) und einer Beugeschwingung (670 cm-1) her rühren. Höher angeregte Zustände sind beim Kohlendioxid bei den atmosphärischen Temperaturen nicht besetzt.
Da alle Kohlendioxidmoleküle (analoges gilt für Wasser) gleich aufgebaut sind erhält man für alle Kohlendioxidmoleküle auch die gleichen Absorptions/Emissions Wellenlängen und nicht etwa ein kontinuierliches Spektrum der Infrarotstrahlung.
Aufgrund der von der Erdoberfläche abgestrahlten und der dann vom „anthropogenen Kohlendioxid“ zurück gestrahlten Infrarotstrahlung soll es nach Meinung einiger „Klimaforscher“ (z.B. im IPCC und im PIK) zu einer steigenden Erwärmung der Erdoberfläche kommen.
Jedoch kann ein Molekül Infrarotstrahlung nur bei der Wellenlänge emittieren, deren Wellenlänge es absorbieren kann (analog einem Rundfunksender und Empfänger deren Frequenzen ebenfalls aufeinander abgestimmt sein müssen. Liegen die Frequenzen auch nur minimal auseinander, dann ist kein Radioempfang möglich). Dieses grundlegende physikalisch-chemische Sender/Empfänger Prinzip stellt die Schlüsselrolle des Wärmeaustausches zwischen der Atmosphäre und der Erdoberfläche dar. Kohlendioxid in der Erdatmosphäre kann also nicht eine x-beliebige Wärmestrahlung, die von der Erdoberfläche abgestrahlt wird absorbieren und wieder Richtung Erde emittieren und umgekehrt kann nicht jedes Molekül auf der Erdoberfläche von der durch Kohlendioxid emittierten Infrarotstrahlung erwärmt werden, weil es diese aufgrund seiner ihm eigenen Moleküleigenschaften gar nicht absorbieren kann. Trifft also das IR-Photon des Kohlendioxids auf einen Stoff, der bei dieser Frequenz nicht absorbiert, kann dieser Stoff auch nicht durch Kohlendioxid erwärmt werden.
Kohlendioxid absorbiert und emittiert bei 2350 cm-1 und 670 cm-1 und Wasser bei 3400 cm-1, 1650 cm-1 und 730 cm-1. Dies bedeutet nichts anderes, als dass Wasser und Kohlendioxid nur in einem sehr schmalen Bereich Wärmestrahlung austauschen können. Insbesondere führen die starken Absorptionen bei 2350 cm-1 (Kohlendioxid) und 3800 cm-1/1650 cm-1 (Wasser) zu keinerlei Wärmeaustausch zwischen diesen beiden Medien und es gibt somit kein „Wärme-Pingpong“ zwischen diesen beiden Akteuren, das zu einer verzögerten Wärmeabgabe führen würde, wie dies oft behauptet wird. Oder einfach gesagt, das Kohlendioxid in der Atmosphäre lässt den Ozean völlig kalt.
Bei 670 cm-1 überlappen die Absorptionen von Wasser und Kohlendioxid zwar, ein Hin und Her an Wärme wäre denkbar. Allerdings ist sehr viel mehr Wasser in der Atmosphäre (ca. 50-100 Mal mehr) als Kohlendioxid. Um hier noch den Beitrag des Kohlendioxids herauszurechnen muss man also äußerst exakt messen. Und selbst wenn es gelänge, was würde man mit einem Ergebnis anfangen, bei dem der Kohlendioxidbeitrag nur noch die alleroberste Spitze des i-Tüpfelchens darstellt? Es ist also nicht so, dass ausgerechnet das „anthropogene Kohlendioxid“ quasi eine Lücke verstopft und die Abstrahlung von Wärme verhindert.
Hingegen wäre natürlich der Wärmeaustausch via Infrarotstrahlung zwischen Wassertropfen in der Atmosphäre und Wasser im Ozean denkbar, denn hier passen die Wellenlängen bei allen Absorptionsbändern exakt aufeinander. Wenn die vom Wasserdampf der Atmosphäre zurück gestrahlten IR-Photonen vom Wasser im Ozean wieder absorbiert werden, wird Wärme in den Ozean zurück transportiert. Diese Wärme wurde jedoch zuvor beim Abstrahlen des IR-Photons aus dem Ozean entnommen, so dass sich in der Gesamtbilanz keine Erwärmung ergeben kann! Weiterhin wird Infrarotstrahlung radial, das heißt in alle Richtungen abgestrahlt (und nicht etwa nur in Richtung der Erdoberfläche) die Hälfte der IR-Photonen verschwindet also auf Nimmerwiedersehen ins Weltall, was zu einer Abkühlung führt.
Hingegen haben das Edelgas Argon sowie Stickstoff und Sauerstoff nicht die Fähigkeit Wärme in das Weltall abzustrahlen.
Kohlendioxid ist also aufgrund seiner physikalisch-chemischen Eigenschaften tatsächlich nicht in der Lage, die Erde durch ein Hin und Her der Wärmestrahlung zu erwärmen, wie es von manchen sogenannten Klimaexperten gebetsmühlenartig behauptet wird. Solange es auf der Erde keine oder nur geringfügig Medien gibt, die bei Wellenlängen von 2350 cm-1 oder 670 cm-1 (Kohlendioxid) IR-Photonen absorbieren, spielt es überhaupt keine Rolle wie hoch die CO2-Konzentrationen in der Atmosphäre sind; sie sind nicht im Stande, die Erdoberfläche zu erwärmen. Es ist doch sehr auffällig, dass in der Politik oder von sogenannten Aktivisten immer nur behauptet wird, die Erwärmung würde am anthropogenen Kohlendioxidausstoß liegen, aber nie jemand auch nur im Ansatz die physikalisch-chemischen Vorgänge dazu erläutert.
Correctiv.Org, welches von Soros finanziert wird, beurteilt physikalisch richtige FB-Beiträge basierend auf dem PIK Deutschland als falsch! Das ist in etwa das gleiche, wie wenn man E = MC^2 von Einstein plötzlich als falsch beurteilen würde, ohne spezifisch auf die physikalischen Gründe einzugehen. Correctiv.org und das PIK verändern auf Irreführende kriminelle Weise längst in den Literaturen wissenschaftlich gesicherte Gesetzmässigkeiten!
Kohlendioxid besitzt eine hohe Dichte und wiegt etwa das 1,5fache von Luft. Damit ist es das schwerste Gas in der Luft. CO2 absorbiert in den Bereichen 2.75, 4.25 und um 15 Micrometer wärme. Die aufnehmbare Wärme ist jedoch begrenzt, bzw. CO2 ist bereits mit der geringen Menge in Bodennähe in der Atmosphäre zu 80% mit Wärme gesättigt. Da CO2 schwerer als Luft ist, verhält es sich entsprechend und fliesst in der Regel in Richtung Bodennähe. Durch Konvektion wird CO2 in der untersten Atmosphärenschicht etwas durcheinander gewirbelt. In ca. 10-12 Kilometer Höhe beträgt der Anteil an CO2 noch ca. 4 Molekühle auf 1 Million. Das Spurengas CO2 ist nicht nur für den Calvin-Zyklus elementar wichtig, sondern spielt auch für die Wärmeableitung in der Atmosphäre eine sehr wichtige Rolle. Umso mehr CO2 in höheren Luftschichten vorhanden ist, umso besser wird Wärme ins All abgeleitet. Getreu des 2. Thermodynamischen Hauptsatzes. Ausserdem wird CO2 für den Pflanzenwachstum zwingend benötigt. Ohne CO2 gäbe es auf der Erde keine Biosphäre. Umso mehr CO2 anteilig in der Atmosphäre vorkommt, desto grösser wird die Biosphäre. Dies hatten wir bereits im Artikel vom 17.11.2017 detailliert aufgezeigt und auf die Studie vom "Lead author Zaichun Zhu from Peking University" hingewiesen.
Vielen ist es vielleicht nicht bewusst, aber im Hochsommer, wenn sich eine Wolke vor die Sonne sdchiebt, wird es schnell etwas kühler. Die Ursache dafür ist Wasserdampf vermischt mit Wassertröpfchen, welche sich als Wolke bemerkbar machen. Diese verhindern das durchscheinen der Infrarot Strahlung und reflecktieren diese zurück in die oberen atmosphärischen Luftschichten. Hingegen wenn es im Winter in der Nacht wolkenfrei wird, wird es gleich fühl- und messbar kühler. Die Differenz kann bis zu 10 Grad betragen. Bei gleichen Bedingungen, jedoch Wolkenbedeckt, reflecktiert Wasserdampf die Wärme auf die Oberfläche zurück.
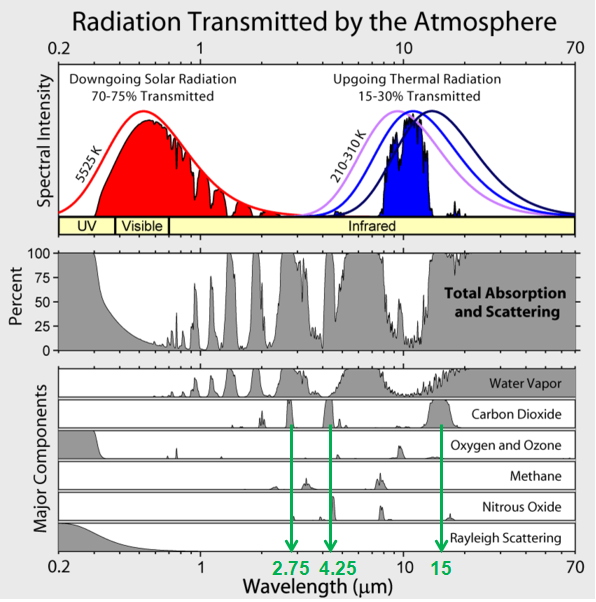
In der obigen Graphik ist sehr schön zu erkennen, dass CO2 in sehr schmalen Linien Wärme absorbiert. Ganz oben in der Graphik sind die Bereiche der solaren Einstrahlung (rot) und der Bereich (blau), in dem Wärme von der Erde und Atmosphäre wieder abgestrahlt wird. Die Infrarot Linien 2.75 und 4.25, bei denen CO2 wärme aufnehmen kann, spielen bei der Emission gemäss dieser Graphik keine Rolle und sind daher für die Atmosphärischen Vorgänge Irrelevant. Genau gleich verhält es sich bei 13-17 Mikrometer, wo CO2 nur extrem geringfügig Wärme emittiert, im Verhältnis zur gesamten emittierten Wärme. Der Infrarot-Bereich zwischen ca. 8 und 12 Mikrometern, bei dem Wärme in das All abgestrahlt wird, wird durch kein einziges Atmosphärengas behindert. Dies wirkt bei der Wärmeableitung wie ein offenes Fenster.
Wieso kann CO2 keinen Einfluss auf die Wärme der Atmosphäre nehmen?
Im Internet wird immer wieder behauptet, dass CO2 durch die Erhöhung von 350 ppm auf 403ppm in den letzten 30-40 Jahren eine erhöhte Rückkopplung im Zusammenhang mit Wasserdampf bewirken würde und damit die Atmosphäre zusätzlich aufheizen würde. Diese Behauptung ist völliger Schwachsinn und basiert auf falschen Annahmen. Oftmals wird auch das Schülerexperiment mit zwei Glasbehältern und einem schwarzen Strahler erwähnt, bei dem CO2 in die Behältnisse eingefüllt wird. Dass jedoch dabei der Anteil des CO2 in diesem Experiment teilweise über 80% liegt, ist es nur logisch, dass eine Wärmedifferenz um 1 Grad gemessen werden kann. Rechnet man diese 1 Grad (oder auch etwas mehr) auf den anthropogenen Anteil von ca. 4% der 0.04% des CO2 Anteils in der Atmosphäre um, erhält man im Verhältnis eine realistische Erwärmung von 0.00003 Grad.
Seit dem Ende der kleinen Eiszeit 1860 stieg die CO2 Konzentration von ca. 280ppm (0.028%) auf ca. 410ppm (0.041%). Das sind seit 1860 bis Heute 130ppm (0.013%).
Von diesen 130ppm sind und das ist wissenschaftlich dutzendfach belegt, ca. 4% anthropogenem Ursprungs. Die restlichen 96% der 130ppm stammen aus Ausgasungen der Ozeane.
4% von 0.013% sind 0.00052% oder 5.2ppm weltweit anthropogener Herkunft. Die Schweiz emittierte von diesen 0.00052% nur 0.8%, was 0.000000416% oder 0.0416ppm auf Tausend Moleküle entspricht.
Was die physikalischen Eigenschaften anbelangt, ist CO2 nur bei 15µm in der Lage, Quantenmechanisch unter Einfluss der IR-Strahlung in den angeregten Zustand zu gelangen. Im angeregte Zustand ist die Lebensdauer der Anregung 6µs auf Meereshöhe. Das bedeutet, dass bereits vor dem Anstieg CO2 fast vollständig gesättigt war und der Anstieg seit dem Ende der kleinen Eiszeit absolut keine Wirkung mehr hat.
Anmerkung: Das ist ein umstrittenes Thema, und ich habe mich oft davor gescheut, weil es in Nahrungskämpfen oft ausbricht. Mr. Gill bemüht sich hier jedoch mit gutem Glauben und stellt einige wichtige Fragen, die ich für eine Diskussion lohnenswert halte. Sein ursprünglicher Versuch war ohne Grafiken, und ich habe zwei relevante Graphiken hinzugefügt, um in der Diskussion zu helfen. Antonius
Weist Wiens Gesetz und Quantenphysik 101 nach, dass CO2 nichts erwärmen kann?
Gastbeitrag von Rod Gill
WUWT hat mit Freude viele Wege aufgezeigt, wie CO2 keine messbare Erwärmung produziert. Ich habe über einen anderen Weg nachgedacht. Es ist so einfach, ich muss etwas verpasst haben, aber ich kann einfach nicht herausfinden, was. Es geht so...
Experten gehen davon aus, dass es eine langwellige Infrarotstrahlung (LWIR) von 2W/m2 gibt, die die globale Erwärmung verursacht. Ich schlage vor, dass die Qualität dieses 2W der Strahlung zur Bestimmung entscheidend ist, ob sie irgendeine atmosphärische Erwärmung überhaupt verursacht. Erstens einige Kernpunkte, die meines Erachtens Fakten sind und nicht umstritten sind.
Mein Verständnis von Thermodynamik und Strahlung von CO2 ist wie folgt:
- In der Thermodynamik ist die Temperatur die durchschnittliche kinetische Energie der Teilchen in einem Körper (fest oder gasförmig).
- Die Temperatur eines Luftvolumens hat nichts mit der Menge an Strahlung zu tun, die durch sie hindurchgeht (manchmal von Wissenschaftlern als Wärme bezeichnet). Solange diese Strahlung nicht auf einer Frequenz ist, die von der Luft absorbiert werden kann, ist ihre Temperatur von der Strahlung völlig unbeeinflusst (ohne jegliche Konvektionsheizung). z. B. auf dem Gipfel des Mount Everest gibt es dort viel Sonnenenergie (lange und kurze Wellenstrahlung), wenn die Sonne scheint, die Temperatur aber immer noch kalt ist.
- Verschiedene Gase haben unterschiedliche Emissionsspektren. Zum Beispiel absorbieren oder emittieren Sauerstoff und Stickstoff keine langwellige Infrarotstrahlung (LWIR) und werden daher nicht als "Treibhausgase" betrachtet.
- Die Temperatur eines Körpers (Gas, Flüssigkeit oder Feststoff) beeinflusst direkt die Wellenlänge der Strahlung, die er emittiert und absorbiert.
- Die Temperatur eines Körpers (Gas, Flüssigkeit oder Feststoff) beeinflusst direkt die Wellenlänge der Strahlung, die er emittiert und absorbiert.
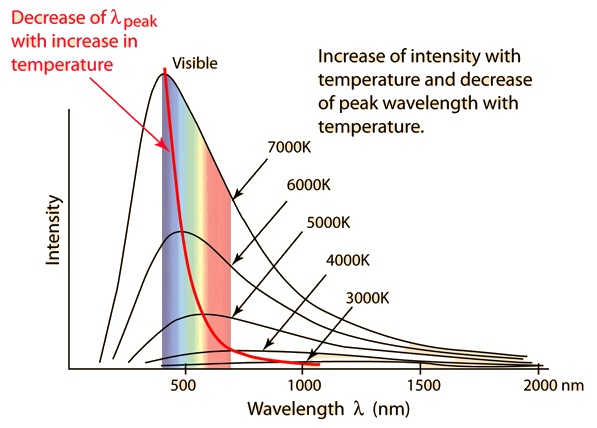
Das Absorptionsspektrum von Kohlendioxid zeigt, dass es LWIR bei drei verschiedenen engen Wellenlängen absorbiert. Zwei dieser Wellenlängen treten bei Temperaturen auf, die zu heiß sind, um in der Atmosphäre zu existieren, die verbleibende Wellenlänge beträgt 15 um.
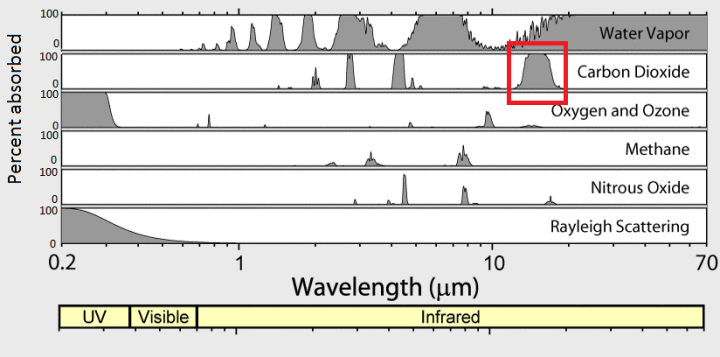
15um entspricht 2898 ÷ 15 = 193K = -80C oder -122F. In der Atmosphäre tritt diese Temperatur nur etwa 90-100 km hoch in der Atmosphäre auf.
Kohlendioxid emittiert und absorbiert Strahlung nur bei -80°C von einer engen Schicht Atmosphäre 90 km über der Erdoberfläche.
Jetzt müssen wir also die Qualität dieser 15 um-Strahlung und ihre Fähigkeit, die untere Atmosphäre zu erwärmen, untersuchen. Dazu müssen wir die Grundlagen der Quantenphysik verstehen, wie sie in 101 Vorlesungen für Physik- und Ingenieurstudenten an der Universität gelehrt werden. Geständnis:
Ich bin Ingenieur, aber ausgebildet, bevor die Quantenphysik in Universitätskurse eingeführt wurde, so dass ich Autodidakt bin, daher brauche ich eine Vernunftprüfung. Da kommen Sie ins Spiel, lieber Leser.
Die Eckpunkte in der Quantenphysik, was die Strahlungswärmeübertragung betrifft, sind:
- Moleküle haben ein oder mehrere Elektronen, die sie umkreisen. Ihre Umlaufhöhe ist nicht variabel, sondern fest eingestellt. Die Elektronen umkreisen nur in bestimmten Höhenlagen, je näher am Molekül, desto geringer ist die kinetische Energie des Moleküls und desto niedriger die Temperatur des Moleküls.
- Damit sich ein Molekül aufwärmen kann (mit mehr kinetischer Energie), braucht es seine Elektronen, um sich in eine höhere, energetischere Umlaufbahn zu bewegen. Dies kann auf zwei Arten geschehen: entweder durch Kollision mit einem energetischeren Molekül oder durch Strahlung.
- Damit sich ein Elektron auf eine höhere Umlaufbahn aus Strahlung bewegen kann, muss es ein Photon mit ausreichender Energie empfangen, damit ein Elektron diese höhere Umlaufbahn erreichen kann.
- Photonen mit zu viel Energie heben das Elektron auf die höhere Umlaufbahn, dann strahlt das Molekül sofort überschüssige Energie wieder ab.
- Photonen, die nicht genügend Energie haben, um die Umlaufbahn eines der Elektronen anzuheben, werden entweder gestreut oder sofort nachgestrahlt (effektiv reflektierend oder streuend), ohne dass sich die kinetische Energie oder Temperatur des Moleküls ändert.
- Das Photon muss eine Frequenz haben, die mit dem Molekül mitschwingt, ansonsten wird das Photon sofort gestreut oder reflektiert, ohne dass es zu einer Temperaturänderung des Moleküls kommt.
- Kohlendioxid kann nur Langwellige Infrarotstrahlung (LWIR) absorbieren und bei 15 Mikrometern, einem Bruchteil des LWR-Spektrums, abstrahlen.
- Elektronen, die Moleküle einer Flüssigkeit oder eines Festkörpers umkreisen, benötigen mehr Energie, um den Orbit eines Elektrons zu verstärken, als Elektronen in einem Gas, benötigen also wieder mehr energetische Photonen, um sie zu erwärmen.Daher verstehe ich, dass es dem LWIR, der von einem kalten CO2-Molekül mit niedrigem Energiebedarf emittiert wird, unmöglich ist, die notwendige Energie zu haben, um ein Molekül in der Atmosphäre wärmer als -80C zu erwärmen und sicherlich kein Molekül in einer Flüssigkeit (EG-Wasser) oder einem Festkörper, da ihre Elektronen noch mehr Energie benötigen.
- LWIR aus CO2 springt einfach um die Atmosphäre herum, bis es in den Weltraum entweicht und keine Erwärmung der unteren Atmosphäre verursacht. Das Energieniveau dieser 2W von LWIR ist zu gering, um irgendwelche Auswirkungen zu haben. Es muss näher bei 10um sein, um energetisch genug zu sein, um etwas zu erwärmen.
Der Gedanke, Wärme in der Atmosphäre mit CO2 einzufangen, ist also falsch. Ja, LWIR aus CO2 wird länger in der Atmosphäre zurückgehalten, aber es hüpft einfach herum, bis es in den Raum entweicht, ohne eine Erwärmung zu verursachen.
Also habe ich Recht? Ich habe absichtlich keine Hinweise angefügt, weil ich möchte, dass Sie mein Verständnis unabhängig bestätigen oder verneinen. Wenn ich Ihnen meine Referenzen gegeben habe, die das Web kennen, kann es sein, dass Sie irrtümlich zu den gleichen Schlussfolgerungen kommen wie ich. Ich habe jedoch versucht, meine Forschung auf Universitätsarbeiten und Vorlesungsunterlagen zu beschränken, in der Hoffnung, dass sie zuverlässiger sind.
Wenn ich das richtig verstanden habe, ist CO2 verursachte globale Erwärmung nicht möglich. Wenn ich das nicht richtig verstanden habe, wie genau erwärmt LWIR von CO2 überhaupt etwas?
Vielen Dank und bitte beschränken Sie Ihre Kommentare auf die oben genannten Details. Und wenn Sie mit der obigen Wissenschaft nicht einverstanden sind, erklären Sie bitte, mit welchen Sätzen Sie nicht einverstanden sind und wie genau auf der Ebene der Quantenphysik Photonen eines CO2-Moleküls bei -80C alles erwärmen können.
Seit dem Ende der kleinen Eiszeit 1860 bis Heute beträgt der CO2 Anstieg 130ppm. Ein grosser Teil davon wurde durch die Zunahme der solaren Aktivität bis 1988 aus den Meeren ausgegast. Der natürliche Anteil beträgt 96%.
Der anthropogene Anteil von diesen 130ppm beträgt 4%, gemäss aktuellem Forschungs-Stand.
4% von 0.013% = 0.00052% oder 5.2ppm.
Ein Liter CO2 wiegt 1,96 Gramm
Nun sollte man noch wissen, wieviele CO2 Moleküle 1 Liter enthält.
Ein Mol – das ist die gebräuchliche Mengeneinheit von Atomen und Molekülen – sind 602 Trilliarden Teilchen. Bei Gasen hat ein Mol ein Volumen von 22,4 Litern. Entsprechend der atomaren Masse von Sauerstoff von 16 Gramm je Mol und Kohlenstoff von 12 Gramm je Mol, wiegt ein Mol CO2, also 22,4 Liter, 44 Gramm.
25 g Kohlenstoffdioxid entsprechen der Stoffmenge von 0,57 mol. Darin sind 3,42 • 10^23 342.000.000.000.000.000.000.000 = 342 Trilliarden) CO2-Moleküle enthalten.
Für das Gesamtgewicht der Atmosphäre gilt
5'130'000'000'000'000 Tonnen
1000 Liter Luft entsprechen bei einem atmosphärischen Druck auf Meereshöhe 1293 Gramm.
25 Gramm = 0.57mol = 342'000'000'000'000'000'000'000 Moleküle.
410ppm = 0.00000000000000000003 Gramm
1293/100*0.041 = 0.53013 Gramm in 1'000L Luft.
In Tonnen = 0.00000053013
Das atmosphärische CO2 Gesamtgewicht beträgt
T/T2*CO2T = 5'130'000'000'000'000 / 0.001293 * 0.00000053013 = 2'103'300'000'000 Tonnen
Davon 4% anthropogener Anteil sind 84'132'000'000
Tonnen.
Bei 7 Milliarden Menschen wäre der Anteil pro Kopf demnach 84'132'000'000 / 7000000000000
= 0.012018857 Tonnen oder 12.018857 Kilo pro Kopf.
Gegenprüfung der Berechnung:
5'130'000'000'000'000 Tonnen
Davon 0.041% = 2'103'300'000'000 Tonnen
Davon 4% Anth. = 84'132'000'000 Tonnen

